Calor Específico (c).
Suponha que diferentes objetos fabricados de diferentes materiais são
aquecidos da mesma forma. Será que os objetos vão esquentar na
mesma velocidade? A resposta é: na maioria das vezes não.
Diferentes materiais se aquecem a diferentes velocidades, porque cada
material tem o seu próprio calor específico.
O calor específico indica a capacidade de calor necessária para
aquecer uma unidade de massa (uma grama ou um kilo), de modo que sua
temperatura aumente de 10 C. No SI a unidade de calor
específico é J/kg 0K. (Joule por kilograma por graus
Kelvin), mas também pode aparecer a cal/g 0C (caloria por
grama por graus Celsius). Quanto menor o calor específico de
uma substância, mais facilmente ela pode aumentar ou diminuir sua
temperatura (esquentar ou esfriar) ou então, quanto maior for o
calor específico de uma substância, mais difícil será elevar a
sua temperatura.
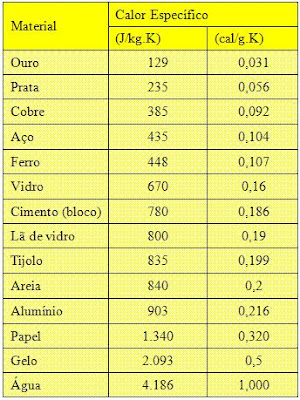
As tabelas a seguir mostram os calores específicos de algumas
substãncias. Note que o calor específico da água é muito maior do
que o das outras substâncias.
Na tabela de baixo, temos na primeira coluna os valores no SI.
Na tabela de baixo, temos na primeira coluna os valores no SI.
Podemos
ver nas tabelas que o calor específico da água é maior que o das
outras substâncias. Por esse motivo, ela é utilizada para a
refrigeração de motores de automóveis. Além disso, a grande
quantidade de energia necessária para a água variar sua temperatura
é um fator fundamental para a estabilidade climática de
algumas regiões da Terra.
É
por isso que as variações de temperatura entre o dia e a noite nos
desertos são enormes, enquanto em regiões com muita água são bem
menores, isto é, areia não retém o calor do Sol, quando chega a
noite (veja nas tabelas acima a diferença de calores específicos
entre elas).
Capacidade Térmica ( C ).
Definição: É a quantidade
de calor que um corpo precisa receber ou perder para que a sua
temperatura aumente ou diminua de 10
C.
A capacidade térmica é
porporcional à quantidade de massa de um corpo. Assim, dois corpos
feitos do mesmo material, mas com massas diferentes, terá maior
capacidade térmica o corpo que possuir maior
massa.
Vamos colocar duas panelas A e B no fogão. Na panela A colocamos
mais água do que na panela B.
Se quisermos que a água das duas panelas fiquem com a mesma
temperatura, digamos 700 C. Deveremos fornecer maior
quantidade de calor à panela que contém maior quantidade de
água (maior massa).
Ou então, se fornecermos a mesma quantidade de calor (os botões do
fogão na mesma marca). A panela que tem mais água irá ficar menos
aquecida.
Estes fatos acontecem porque a maior quantidade de água da panela A
possui maior capacidade térmica,
pois necessita de uma quantidade maior de calor do que a água da
panela B.
Unidade da Capacidade Térmica.
No SI, sua unidade é o J/K
(Joule por Kelvin), contudo ela pode aparecer como cal/0C
(calorias por graus Celsius).
Assim, a panela A pode ter uma
capacidade térmica CA
= 20 cal/0C,
enquanto a água da panela B pode ter uma capacidade térmica CB
= 10 cal/0C.
Isto é, são necessárias 20 calorias para aumentar um grau na
panela A, enquanto que na B, apenas 10 calorias são necessárias.
Equação da Capacidade Térmica
Podemos calcular a CapacidadeTérmica através da expressão:
ΔT
= Tf
- Ti
Q – quantidade de calor recebida pelo corpo;
Tf
– temperatura final do corpo;
Ti
– temperatura inicial
do corpo.
Exemplo: Um forno de
pizzaria fornece cerca de 810000 calorias para assar uma pizza.
Sabendo-se que ela se encontrava a uma temperatura de 250
C antes de ir ao forno e quando ficou pronta, atingiu uma temperatura
de 3250
C, determine a CapacidadeTérmica da pizza.
Solução:
C = Q / ΔT
ΔT = Tf
– Ti
Q = 810000 cal
Ti
= 250
C
Tf
= 3250
C
ΔT
= 325 – 25 = 3000
C
C = 810000/300 = 2700
Q = 2700 cal/0C
Vejamos agora alguns vídeos sobre calor específico e capacidade térmica:
Calor específico vídeo 1:
Calor específico vídeo 1:
Calor específico vídeo 2:
Calor específico vídeo 3:
Capacidade Térmica, vídeo 1:
Capacidade térmica, vídeo 2:
Capacidade térmica, vídeo 3
Vamos agora, refazer os exercícios no seu caderno.





Nenhum comentário:
Postar um comentário